Krakowskie Centrum Badań i Technologii Medycznych
Lokalizacja: Prądnicka 80, 31-202 Kraków (Budynek M9)
Kontakt: tel. 12 614 21 08,
Godziny pracy: 8:00-15:35
Cennik badań diagnostycznych i leczniczych (dla zleceniodawców zewnętrznych).
Krakowskie Centrum Badań i Technologii Medycznych jest jedynym w Polsce ośrodkiem wykonującym badania w zakresie oceny czynnościowej i obrazowej charakterystyki skrzepu fibrynowego. Ośrodek współpracuje z licznymi instytucjami w kraju i za granicą, co pozwala na wymianę doświadczeń i gwarantuje najwyższe standardy badawcze. Pracownia dysponuje wyposażeniem pozwalającym na prowadzenie badań naukowych w zakresie:
- oceny właściwości skrzepów fibrynowych,
- oceny osoczowego potencjału do generowania trombiny,
- ocena stopnia kontrakcji i morfologii skrzepu wytworzonego z krwi pełnej,
- wykonywania testów ELISA,
- prowadzenia analiz mikroskopowych preparatów tkanek i komórek z wykorzystaniem technik skaningowej mikroskopii elektronowej (pow. do 60 000x) oraz mikroskopii fluorescencyjnej,
- prowadzenia hodowli komórkowych,
- przechowywania materiału biologicznego w temperaturze -80o.
W Krakowskim Centrum Badań i Technologii Medycznych funkcjonują trzy pracownie:
- pracownia Diagnostyki Chorób Zakrzepowo-Zatorowych,
- pracownia Innowacyjnych Zastosowań Komórek Macierzystych,
- pracownia Badań Genetycznych.
Wykonywane badania
Ocena właściwości skrzepów fibrynowych
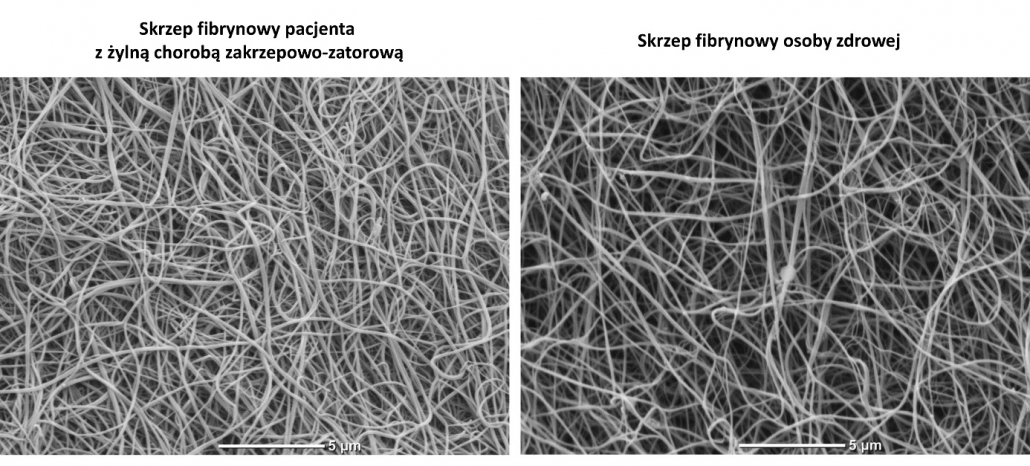
Nieprawidłowa struktura i czynność skrzepu fibrynowego, a w szczególności zwiększona gęstość sieci fibryny oraz jej odporność na fibrynolizę mają związek z chorobami układu krążenia (CVD), w tym z ostrym zawałem mięśnia sercowego, stabilną chorobą wieńcową, udarem niedokrwiennym mózgu, chorobą tętnic obwodowych, jak również z większą częstością występowania żylnych incydentów zakrzepowo-zatorowych i ich nawrotów.
Przepuszczalność sieci fibrynowej (Ks) jest najczęściej stosowaną metodą do określania struktury sieci fibryny, która odzwierciedla wielkość porów pomiędzy włóknami fibryny, poprzez pomiar objętości cieczy przepływającej przez żel fibrynowy w określonym czasie i wystandaryzowanych warunkach. Ks można oznaczać w dwóch wariantach, w których krzepnięcie osocza krwi może być inicjowane za pomocą egzogennej trombiny (najczęściej stosowana metoda) lub czynnika tkankowego (np. podczas badania wpływu antykoagulacji na strukturę sieci fibryny).
Materiał do badań: około 300 µl osocza cytrynianowego ubogopłytkowego odwirowanego do 30 minut od pobrania krwi w temperaturze pokojowej (20 minut przy 2500g) i przechowywanego w temperaturze -80oC lub w -20oC do 30 dni.
Czas oczekiwania na wynik: do 7 dni roboczych (w przypadku >100 próbek czas wykonania jest szacowany indywidualnie).
Ks obliczany wg formuły: Q × L × η/t × A × Δp
Q – objętość buforu w czasie t
L – długość kolumny z żelem (cm)
η- lepkość buforu (puaz)
A – powierzchnia przekroju (cm2)
Δp – różnica ciśnień (dyna/cm2)
t – czas pomiaru (60 min)
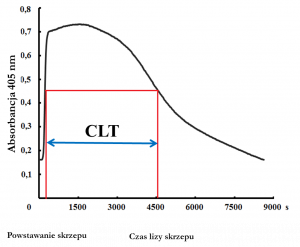
Czas lizy skrzepu (CLT) mierzony jako czas niezbędny do degradacji skrzepu fibrynowego w ściśle określonych warunkach. CLT można oznaczać w trzech wariantach, tzn. metodą wg. Pieters i wsp. (J Thromb Haemost. 2018;16:1007-12), wg. Lismana i wsp. (Gastroenterology. 2001;121:131-9) lub wg. Carter i wsp. (Arterioscler Thromb Vasc Biol. 2007;27:2783-9) wybranych w zależności od charakterystyki grupy badań, z możliwością dalszej modyfikacji.
Materiał do badań: około 300 µl osocza cytrynianowego ubogopłytkowego odwirowanego do 30 minut od pobrania krwi w temperaturze pokojowej (20 minut przy 2500g) i przechowywanego w temperaturze -80oC lub w -20oC do 30 dni.
Czas oczekiwania na wynik: do 7 dni roboczych (w przypadku >100 próbek czas wykonania jest szacowany indywidualnie).
Połączenie testów przepuszczalności i czasu lizy skrzepu ma dodatkową zaletę polegającą na powiązaniu struktury skrzepu z jego odpornością na degradację. Ponadto, dodatkowa analiza struktury skrzepu za pomocą metody skaningowej mikroskopii elektronowej pozwala na wszechstronną charakterystykę fenotypu skrzepu osoczowego.
Ocena potencjału do generacji trombiny
Oznaczenie potencjału do generacji trombiny w osoczu cytrynianiowym wykonywane jest metodą Kalibrowanego Automatycznego Trombogramu (CAT, Diagnostica Stago) z wykorzystaniem wystandaryzowanych odczynników.
Możliwa jest ocena trzech podstawowych wariantów generowanej trombiny, z użyciem odczynników o uśrednionym poziomie czynnika tkankowego, z niskim stężeniem czynnika tkankowego (zalecany u pacjentów z hemofilią i wykazujący wrażliwość na VIII, IX i XI czynnik krzepnięcia) oraz z wysokim stężeniem czynnika tkankowego (zalecany u pacjentów antykoagulowanych). Możliwe jest również oznaczanie generacji trombiny w osoczu bogatopłytkowym oraz generacji trombiny na mikrocząstkach w osoczu ubogopłytkowym.
Materiał do badań (w zależności od metody):
- około 500 µl osocza cytrynianowego ubogopłytkowego odwirowanego do 30 minut od pobrania krwi w temperaturze pokojowej (20 minut przy 2500g) i przechowywanego w temperaturze -80oC lub w -20oC do 30 dni.
- około 500 µl osocza cytrynianowego bogatopłytkowego odwirowanego do 30 minut od pobrania krwi w temperaturze pokojowej (10 minut przy 160g) i przechowywanego w temperaturze -80oC lub w -20oC do 30 dni.
Czas oczekiwania na wynik: do 7 dni roboczych (w przypadku >100 próbek czas wykonania jest szacowany indywidualnie).
Powyższe badania nie są badaniami diagnostycznymi, ale mogą służyć jako badania pomocnicze w interpretacji innych wyników związanych z zaburzeniami hemostazy.
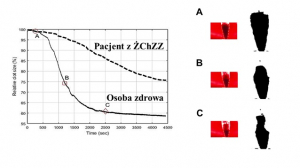
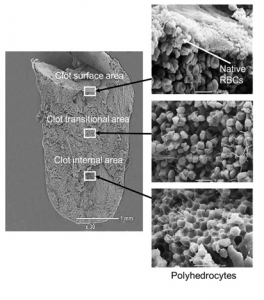
Ocena stopnia kontrakcji i morfologii skrzepu wytworzonego z krwi pełnej
Ocena stopnia kontrakcji skrzepu w układzie makroskopowym pozwala na oszacowanie in vitro zdolności skrzepu do „obkurczania” w wyniku aktywacji krzepnięcia. Udowodniono, że upośledzona zdolność do kontrakcji skrzepu występuje np. u pacjentów z udarem mózgu (Tutwiler V, et al. Arterioscler Thromb Vasc Biol. 2017;37:271-9) czy z rezydualną niedrożnością żył (Zabczyk M, Natorska J, Undas A. J Thromb Thrombolysis. 2018;46:31-8).
Materiał do badań: około 1000 µl pełnej krwi cytrynianowej dostarczonej w temperaturze pokojowej do 60 minut od pobrania krwi.
Czas oczekiwania na wynik: do 7 dni roboczych.
Ponadto, ocena mikroskopowa skrzepu wytworzonego z pełnej krwi cytrynianowej po aktywacji krzepnięcia za pomocą trombiny umożliwia ocenę składu skrzepliny, w tym zawartości fibryny i elementów morfotycznych krwi. Metoda ta pozwala na identyfikację np. polihedrocytów, które powstają w wyniku odkształcania powierzchni erytrocytów pod wpływem działających na nie sił w wyniku aktywacji krzepnięcia.
Materiał do badań: około 500 µl pełnej krwi cytrynianowej dostarczonej w temperaturze pokojowej do 60 minut od pobrania krwi.
Czas oczekiwania na wynik: do 7 dni roboczych.
Analizy mikroskopowe
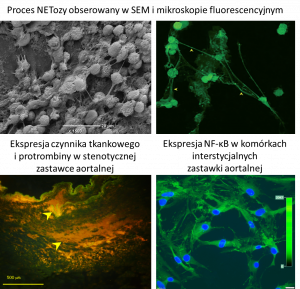
Pracownia wykonuje preparatykę tkanek i komórek do celów skaningowej mikroskopii elektronowej (pow. do 60 000x) oraz mikroskopii fluorescencyjnej. Ośrodek dysponuje aparatem do suszenia utrwalonych i odwodnionych preparatów w punkcie krytycznym (Samdri PVT-3D) oraz napylarką próżniową (JEOL JFC-1300) umożliwiającą następnie prowadzenie analiz w mikroskopie skaningowym (JEOL JCM-6000).
Materiał do badań: Materiał świeży dostarczony do 24 godzin od pobrania/przygotowania w soli fizjologicznej/izotonicznym buforze lub utrwalony i odwodniony, dostarczony w 70% alkoholu etylowym.
Czas oczekiwania na wynik: do 7 dni roboczych.
Pracownia wykonuje preparaty mrożeniowe (kriostat Leica CM 1520) do celów analiz immunofluorescencyjnych (mikroskop Olympus BX 43 wyposażony w oprogramowanie cellSense Dimension 2.3).
Materiał do badań: Materiał świeży dostarczony do 24 godzin od pobrania/przygotowania w soli fizjologicznej/izotonicznym buforze lub utrwalony w kriomedium, np. Tissue Tec-OCT i dostarczony w formie zamrożonej.
Czas oczekiwania na wynik: do 7 dni roboczych.
Pracownicy
Stopień doktora uzyskała w roku 2006, doktora habilitowanego nauk medycznych w roku 2017, a w roku 2023 objęła stanowisko profesora Uniwersytetu Jagiellońskiego.
Stopień doktora uzyskała w roku 2006, doktora habilitowanego nauk medycznych w 2017 roku.
Od roku 2001 prowadzi badania naukowe jako główny wykonawca i wykonawca wielu projektów badawczych finansowanych ze środków Komitetu Badań Naukowych oraz Narodowego Centrum Nauki. W roku 2015 i 2018 otrzymała finansowanie dwóch grantów naukowych w ramach konkursu OPUS Narodowego Centrum Nauki. W roku 2010 współtworzyła Pracownię Badań Autoimmunologicznych w Szpitalu Jana Pawła II wykonującą badania z zakresu autoimmunologii zarówno dla pacjentów przychodni i oddziałów szpitalnych. Od roku 2014 pełni funkcję kierownika nowo otwartych Pracowni Krakowskiego Centrum Badań i Technologii Medycznych w KSS im. Jana Pawła II. Główne zainteresowania naukowe obejmują badanie patomechanizmów prowadzących do rozwoju i progresji stenozy aortalnej, ze szczególnym uwzględnieniem procesów zapalnych oraz aktywacją układów krzepnięcia i fibrynolizy. Prowadząc badania zarówno in loco – w tkance zastawki jak i in vitro – na hodowlach miofibroblastów izolowanych ze stenotycznych zastawek aortalnych oszacowała wpływ miejscowo zachodzących procesów na stan układu hemostazy. Ponadto, bierze udział w badaniach dotyczących wpływu czynników genetycznych i środowiskowych na fenotyp sieci fibrynowej u pacjentów z ryzykiem wystąpienia chorób zakrzepowo-zatorowych.
dr inż. Magdalena Kopytek
Z wykształcenia biotechnolog, w trakcie studiów doktoranckich na Wydziale Lekarskim CM UJ. Od 2017 związana jest z Pracownią Krakowskiego Centrum Badań i Technologii Medycznych. Autorka artykułów naukowych dot. patochmechanizmów prowadzących rozwoju i progresji stenozy aortalnej ze szczególnym uwzględnieniem związków pomiędzy kalcyfikacją, zapaleniem i aktywacją układu krzepnięcia, oraz patobiologii Żylnej Choroby Zakrzepowo-Zatorowej w kontekście oceny zmienności efektu antykoagulacyjnego bezpośrednich doustnych antykoagulantów oraz antagonistów witaminy K i ich wpływu na cechy skrzepu fibrynowego mierzone ex vivo.
Dr hab. n. med. Michał Ząbczyk, prof. UJ
Absolwent UJ CM w Krakowie na kierunku Analityka Medyczna oraz studiów doktoranckich na Wydziale Lekarskim UJ CM. W roku 2016 uzyskał tytuł dr n. med. Od roku 2011 związany z Krakowskim Szpitalem Specjalistycznym im. Jana Pawła II. W latach 2011-2015 odbywał liczne staże w Intytucie Karolinska w Sztokholmie oraz na Uniwersytecie w Leeds a poznane techniki badawcze implementował z powodzeniem do praktyki laboratoryjnej. Ukończył certyfikowane szkolenie oceny osoczowego potencjału generacji trombiny (Maastricht, Holandia). Jest autorem i współautorem ponad 70 prac naukowych z zakresu patofizjologii układu krzepnięcia a wyniki swoich badań prezentował podczas licznych konferencji krajowych i międzynarodowych. Beneficjent grantów Narodowego Centrum Nauki w konkursach PRELUDIUM (2011) oraz SONATA (2019). Otrzymał wyróżnienie za wybitne osiągnięcia naukowe z rąk Marszałka Województwa Małopolskiego (2014) a w roku 2020 został uhonorowany nagrodą Ministerstwa Nauki i Szkolnictwa Wyższego.
 E-Rejestracja
E-Rejestracja